![]()
Produkty restrikčních nebo amplifikačních reakcí (fragmenty DNA) se dělí podle své relativní molekulové hmotnosti a velikosti náboje elektroforézou DNA fragmentů v gelu (Sambrook et al. 1989). Sacharido-fosfátová páteř nukleových kyselin je příčinou rovnoměrného rozložení negativních nábojů v mokelulách DNA a RNA. Pohyb těchto vysoce elekronegativních molekul v elektrickém poli vede k jejich separaci podle molekulové hmotnosti. Větší dělící mohutnosti pro rozdělení velkých fragmentů (až 5000 kb) lze docílit použitím elektroforézy v pulzujícím poli (PFGE). Právě analýza velikosti fragmentů je podstatou interpretace řady molekulárně biologických metod. Nejčastěji se používá jako elektroforetické medium agarosa (0.8 - 3.0 %), jejíž koncentrace se volí podle velikosti fragmentů, které mají být separovány (orientačně viz tabulka).
Velikost fragmentů |
Koncentrace agarosy |
1 - 20 kbp |
0,4 - 0,8 % |
500 - 1000 bp |
2 % |
100 - 500 bp |
3 % |
10 - 100 bp |
5 % |
Mnoho aplikací používá horizontální elektroforézu (např. U= 80-200 V, I = 20-60 mA) a gel je uložen ve svém lůžku ponořen do pufru (TE, TBE, TAE). Nejběžnější aplikace používají dvě velikosti gelů, např. 12 x 20 cm a 5 x 9 cm, což představuje přibližně 4.5, resp. 9 V/cm. Nanášení vzorku (0.1 - 5.0 mg DNA) na start do jamek předchází smíšení s nanášecím pufrem obvykle v poměru 1:4 nebo 1:5, který obsahuje barvu viditelného spektra (např. bromfenolová modř 0.5 g/l, 400 g/l sacharosa, 20 mmol/l EDTA). Rozdělené frakce je možné buď přenést na speciální membrány (fólie) tzv. blotováním a podrobit hybridizaci nebo pomocí fluorescenčních barviv např. ethidiumbromidem interkalací mezi nukleotidy (50 mg/100 ml gelu) vizualizovat na transiluminátoru v UV světle s následnou fotodokumentací. Krokový žebříček po 50 nebo 100 bp (Step ladder) nebo jiné PCR markery se používají jako kalibrační škály molekulové hmotnosti (velikosti fragmentů).
|
PAGE (polyakrylamidová gelová elektroforéza). Druhým nejčastěji používaným elektroforetickým médiem v molekulární biologii je poly- akrylamidový gel (denaturační, obvykle s ureou, nebo nedenaturační). Jedná se o vertikální elektroforézu. Směs akrylamidu a bisakrylamidu polymerizuje při pokojové teplotě v pufru (TAE) pomocí volných radikálů poskytovaných persulfátem amonným (APS), který způsobuje homolytické štěpení vazeb O-O. K urychlení polymerizace se používá volná zásada TEMED (tetrametylendiamin), který katalyzuje tvorbu volných radikálů persulfátu amonného. Jiným užívaným iniciátorem polymerizace je riboflavin, který je účinný již ve velmi nízkých koncentracích 5 -10 ng/l. Polymerizace se neuskuteční při nízkém pH nebo za přístupu O2 . Konečné koncentrace TEMEDu a APS v polymerizačním roztoku by měly být 0,05 %. Použitá koncentrace akrylamidu se liší podle velikosti separovaných fragmentů DNA od 3.5% (fragmenty 1 - 2 kbp) až po 20% gely pro separaci malých fragmentů 10 - 100 bp.
Metoda analýzy SSCP (jednovláknového konformačního polymorfismu, zvaná též SSCA) je jednoduchou, velice senzitivní a efektivní technikou k detekci mutací typu záměny jedné baze (Hayashi et al., 1991). Metoda je založena na principu různé migrace jednovláknových molekul DNA, které se liší svou sekundární strukturou (konformací) v nativním (nedenaturačním) polyakrylamidovém gelu (obvykle 6%, typicky 0.4 mm silný, v TBE pufru). Unikátní konformace jednovláknového fragmentu DNA je dána intramolekulárními interakcemi uvnitř DNA sekvence. Tato konformace je závislá na teplotě a iontové síle. Teplota při elektroforéze je klíčovým para- metrem, který ovlivňuje kvalitu rozlišení DNA proužků. Již tak malý rozdíl jako je záměna jedné baze způsobí změnu konformace a rozdílnou pohyblivost při elektroforéze za dodržení podmínky nedenaturace. Rozdíl v konformaci může tedy být způsoben odlišností pouze jediné baze v sekvenci DNA. Tato vysoce citlivá technika zachycuje 100% mutací v DNA fragmentech menších než 200 bazí a 80% mutací v DNA fragmentech menších než 400 bazí. Optimální velikost PCR produktu je 150 bazí pro detekci mutací, větší PCR produkty jsou vhodné ke sledování polymorfismů. Potřebné zařízení: vhodný zdroj napětí, zařízení pro sekvenační gelovou elektoforézu (20 mA, pokojová teplota) a případně chlazení (45 mA, 4 °C).
Princip SSCP (SSCA)
ds DNA (stejná velikost, odlišná sekvence)
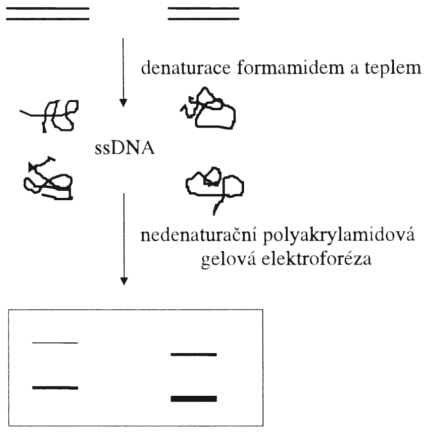
DGGE (denaturační gradientová gelová elektroforéza) je metoda, která umožňuje separaci DNA molekul v polyakrylamidovém gelu na základě odlišné sekvence (liší se v jednom nukleotidu). Gel obsahuje lineární gradient formamidu a močoviny. Dvouvláknová DNA putuje rychlostí určenou její molekulovou hmotností až do doby, než vstoupí do té části gelu, kde je taková koncentrace denaturačních látek, že způsobí denaturaci dsDNA na jednovláknové molekuly. Tím se výrazně změní její pohyblivost. Konečná pozice fragmentu DNA v gelu závisí tedy na denaturačním bodu (melting). Fragmenty identické velikosti mohou být takto separovány na základě odlišné sekvence v gelech s gradientem denaturačního činidla. Gely mají fixní koncentraci akrylamidu (akrylamid : bisakrylamid = 37,5 : 1) v TAE pufru s lineárním gradientem denaturačního činidla (100% = 40% formamid a 7 mol/l urea). Používají se dva typy DGGE: paralelní gely, v kterých se zvyšuje koncentrace denaturačních činidel lineárně od shora dolů ve dvou samostatných paralelních gelech (první 10 - 50%, druhý 40 - 80%); perpendikulární gely, v kterých se zvyšuje koncentrace denaturačních činidel lineárně zleva doprava napříč gelem. Paralelní gely jsou vhodné k vyšetření několika vzorků, perpendikulární gely mají na startu jednu jamku přes celý gel pro jeden vzorek. Nejčastěji používaná strategie je vyšetření klíčového vzorku v perpendikulárním gelu a potom ostatní vzorky z rodokmenu v gelu paralelním. Obvykle používaná koncentrace akrylamidu v této aplikaci je 6 - 8%, separuje se při konstantní teplotě 60 °C, při 150 V po dobu 6 - 10 hodin. Detekce se provádí barvením stříbrem nebo ethidiumbromidem. Denaturačního gradientu lze docílit také gradientem teplotním (metoda TGGE).
Kapilární elektroforéza. Jedná se o alternativní metodu separace fragmentů DNA, která má tyto výhody: minimální spotřeba vzorku (1 - 2 nl o koncentraci 5 - 50 mg/l), rychlost, snadná vizualizace. Separace probíhá v lineárním hydrofilním polymeru v kapiláře (vnitřní průměr 25 - 50 mm, délka několik cm až 1 m) a elektroforetickém pufru podle molekulové hmotnosti. Elektroendosmosa se využívá k zavedení vzorku a dále je eliminová na použitím kapilár se speciální úpravou vnitřního povrchu. K zařízení je připojena přímá detekce měřením absorbance při 260 nm. Typická analýza trvá méně než 20 minut. Pro separaci jednovláknové DNA se používá pufr obsahující ureu (7 mol/l). Systém umožňuje jednoduché změny ve složení pufru.